Problema nº 6 de equilibrio químico, moles - TP02
Enunciado del ejercicio nº 6
A cierta temperatura la constante de equilibrio para la reacción:
CO + H₂O ⇌ CO₂ + H₂
Es K = 0,25.
Si inicialmente existe 3 moles de monóxido de carbono y 3 moles de vapor de agua, cuando se alcanza el equilibrio, ¿cuántos moles de monóxido de carbono quedarán?
Desarrollo
Datos:
K = 0,25
Moles CO = 3
Moles H₂O = 3
Solución
Expresamos la ecuación equilibrada de la reacción:
CO + H₂O ⇌ CO₂ + H₂
x será el número de moles de dióxido de carbono y de hidrógeno en el equilibrio.
Si se forman x moles de dióxido de carbono y x moles de hidrógeno, desaparecen x moles de monóxido de carbono y x moles de agua.
Suponemos que el volumen es constante, por lo tanto, las concentraciones en todos los casos quedan indicados por los valores absolutos de moles de cada sustancia.
[CO] = (3 - x) mol/l
[H₂O] = (3 - x) mol/l
[CO₂] = x mol/l
[H₂] = x mol/l
Aplicamos la fórmula de la constante de equilibrio:
![]()
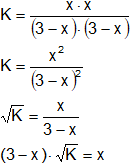
Reemplazamos por los datos y calculamos:
![]()
(3 - x)·0,5 = x
1,5 - 0,5·x = x
1,5 = x + 0,5·x
1,5 = 1,5·x
![]()
x = 1
Respuesta: la cantidad de moles de monóxido de carbono que hay en el sistema es 1
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular los moles dada la constante de equilibrio