Problema nº 10 de equilibrio químico, presiones parciales, moles y presiones parciales de una mezcla de gases - TP03
Enunciado del ejercicio nº 10
Se tiene:
CO(g) + H₂O(g) ⇌ CO₂(g) + H₂(g)
La constante de equilibrio para esta reacción a 986 °C es 0,63. Se mezcla en un recipiente un mol de vapor de agua y tres moles de monóxido de carbono alcanzando el equilibrio a una presión total de 2 atmósferas.
a) ¿Cuántos moles de H₂ hay en el equilibrio?
b) ¿Cuál es la presión parcial de cada gas en la mezcla en el equilibrio?
Desarrollo
Datos:
K = 0,63
pT = 2 atm
Solución
Expresamos la ecuación equilibrada de la reacción:
![]()
a)
Planteamos los moles iniciales y en el equilibrio:
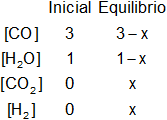
x será el número de moles de CO₂ y H₂ en el equilibrio.
En el equilibrio desaparecen x moles de CO y de H₂O para formar x moles de CO₂ y H₂.
Aplicamos la fórmula de la constante de equilibrio:
![]()
Reemplazamos por los datos y calculamos:
![]()
Aplicamos distributiva del producto con respecto a la resta:
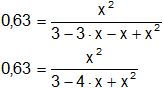
Pasamos de término:
0,63·(x² - 4·x + 3) = x²
0,63·x² - 0,63·4·x + 0,63·3 = x²
0,63·x² - 2,52·x + 1,89 = x²
Igualamos a cero:
0,63·x² - x² - 2,52·x + 1,89 = 0
-0,37·x² - 2,52·x + 1,89 = 0
0,37·x² + 2,52·x - 1,89 = 0
Aplicamos la ecuación de Báscara o Bhaskara:
![]()
Siendo:
a = 0,37
b = 2,52
c = -1,89
Reemplazamos y resolvemos, obtendremos dos valores:
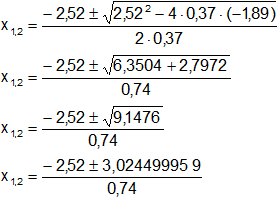
Calculamos los valores de x1,2 por separado según el signo del resultado de la raíz:
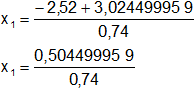
x₁ = 0,681756701
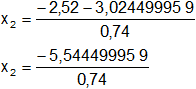
x₂ = -7,492567512 (se descarta por ser < 0)
Respuesta a): la cantidad de moles de H₂ que hay en el equilibrio es 0,68, es la misma cantidad de moles de CO₂.
b)
Del paso anterior sabemos que:
MolH₂ = 0,681756701
MolCO₂ = 0,681756701
Calculamos los moles de CO y de H₂O en el equilibrio:
MolCO = 3 - x = 3 - 0,681756701
MolCO = 2,318243299
MolH₂O = 1 - x = 1 - 0,681756701
MolH₂O = 0,318243299
Aplicamos la fórmula que relaciona las presiones parciales con la fracción molar (Ver Constante de equilibrio de las presiones parciales):
![]()
nT = 4
Reemplazamos:
![]()
pH₂ = 0,34087835 atm.
![]()
pCO₂ = 0,34087835 atm.
![]()
pCO = 1,15912165 atm.
![]()
pH₂O = 0,15912165 atm.
Respuesta b): la presión parcial de cada gas en la mezcla en el equilibrio son.
pH₂ = 0,34 atm.
pCO₂ = 0,34 atm.
pCO = 1,16 atm.
pH₂O = 0,16 atm.
Podemos verificar aplicamos la fórmula de la constante de equilibrio de las presiones parciales:
![]()
Dado que no hay variación entre los volúmenes de reactantes y productos:
Kₚ = K
Reemplazamos:
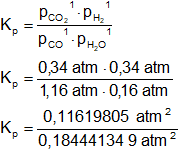
Kₚ = 0,63 ∎
También podemos verificar la pT aplicando la ley de las presiones parciales de Dalton sabemos que:
pT = ∑pg
pT = pCO + pH₂O + pCO₂ + pH₂
Reemplazamos:
pT = 1,15912165 atm + 0,15912165 atm + 0,34087835 atm + 0,34087835 atm
pT = 2 atm ∎
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular los moles y las presiones parciales de una mezcla de gases en el equilibrio