Problema nº 9 de equilibrio químico, principio de Le Châtelier, variación de la temperatura y de la presión - TP03
Enunciado del ejercicio nº 9
Predecir el efecto de un aumento de temperatura y un aumento de la presión, por separado, en las siguientes reacciones en el equilibrio:
a) CO(g) + H₂O(g) ⇌ CO₂(g) + H₂(g)
b) 2·SO₂(g) + O₂(g) ⇌ 2·SO₃(g)
c) N₂O₄(g) ⇌ 2·NO₂(g)
Ver tabla de constantes de entalpías de formación
Solución
a)
CO(g) + H₂O(g) ⇌ CO₂(g) + H₂(g)
Dada la reacción equilibrada, buscamos ΔH:
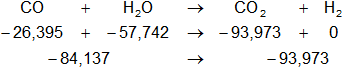
Planteamos la ecuación:
ΔH = Hp - Hr
Reemplazamos:
ΔH = -93,973 - (-84,137)
ΔH = -93,973 + 84,137
ΔH = -9,836 kcal/mol
La reacción es exotérmica. Según el principio de Le Châtelier, un aumento de la temperatura retarda los procesos exotérmicos. La reacción se desplaza hacia la izquierda.
Dada la reacción equilibrada, comparamos los volúmenes de los gases:
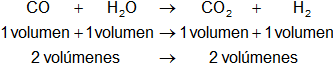
Los volúmenes de los reactantes son iguales a los volúmenes de los productos.
Según el principio de Le Châtelier, el aumento de la presión favorece al lado menor volumen. La reacción no se ve afectada.
b)
2·SO₂(g) + O₂(g) ⇌ 2·SO₃(g)
Dada la reacción equilibrada, buscamos ΔH:
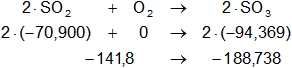
Planteamos la ecuación:
ΔH = Hp - Hr
Reemplazamos:
ΔH = -188,738 - (-141,8)
ΔH = -188,738 + 141,8
ΔH = -46,938
La reacción es exotérmica. Según el principio de Le Châtelier, un aumento de la temperatura retarda los procesos exotérmicos. La reacción se desplaza hacia la izquierda.
Dada la reacción equilibrada, comparamos los volúmenes de los gases:
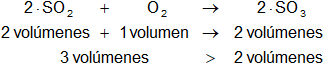
Los volúmenes de los reactantes son mayores a los volúmenes de los productos.
Según el principio de Le Châtelier, el aumento de la presión favorece al lado menor volumen. La reacción se desplaza hacia la derecha.
c)
N₂O₄(g) ⇌ 2·NO₂(g)
Dada la reacción equilibrada, buscamos ΔH:
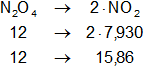
Planteamos la ecuación:
ΔH = Hp - Hr
Reemplazamos:
ΔH = 15,86 - 12
ΔH = 3,86
La reacción es endotérmica. Según el principio de Le Châtelier, un aumento de la temperatura favorece los procesos endotérmicos. La reacción se desplaza hacia la derecha.
Dada la reacción equilibrada, comparamos los volúmenes de los gases:
![]()
Los volúmenes de los reactantes son menores a los volúmenes de los productos.
Según el principio de Le Châtelier, el aumento de la presión favorece al lado menor volumen. La reacción se desplaza hacia la izquierda.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo se comporta una reacción con la variación de la temperatura y de la presión