Problema nº 1 de estequiometria de las reacciones químicas, reactivos y productos - TP01
Enunciado del ejercicio nº 1
¿Qué masa de ácido sulfúrico se podrá obtener a partir de 250 g de azufre 98 % de pureza?
Desarrollo
Datos:
mazufre = 250 g
Purezaazufre = 98 %
Solución
La ecuación de formación del trióxido de azufre es la siguiente:
2·S + 3·O₂ ⟶ 2·SO₃
Calculamos el mol de cada compuesto que interviene en la reacción:
2·S: 2·32,064 g = 64,128 g
3·O₂: 3·(2·15,9994 g) = 95,9964 g
2·SO₃: 2·(32,064 g + 3·15,9994 g) = 160,1244 g
![]()
Mediante regla de tres simple calculamos que masa de azufre puro interviene:
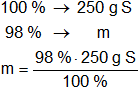
mazufre = 245 g de azufre puro.
Con éste resultado y mediante regla de tres simple calculamos la masa de trióxido de azufre obtenido:
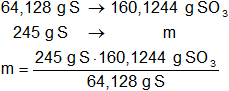
mtrióxido de azufre = 611,7527 g de SO₃ puro.
Luego la ecuación de formación del ácido sulfúrico es la siguiente:
SO₃ + H₂O ⟶ H₂SO₄
Calculamos el mol de cada compuesto que interviene en la reacción:
SO₃: 32,064 g + 3·15,9994 g = 80,0622 g
H₂O: 2·1,00797 g + 15,9994 g = 18,01534 g
H₂SO₄: 2·1,00797 g + 32,064 g + 4·15,9994 g = 98,07754 g
![]()
Con el valor de mtrióxido de azufre y mediante regla de tres simple calculamos la masa de ácido sulfúrico obtenido:
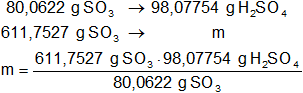
mácido sulfúrico = 749,4074 g de H₂SO₄ puro.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción