Problema nº 8 de estequiometria de las reacciones químicas, reactivos y productos - TP01
Enunciado del ejercicio nº 8
Cuando se trata el cobre con ácido nítrico se produce una reacción según la ecuación:
8·HNO₃ + 3·Cu ⟶ 3·Cu(NO₃)₂ + 2·NO + 4·H₂O
Calcular:
a) ¿Cuántos gramos de ácido nítrico reaccionarán con 200 g de cobre.
b) ¿Qué peso de sal cúprica se obtendrá?
Desarrollo
Datos:
mcobre = 200 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
8·HNO₃ + 3·Cu ⟶ 3·Cu(NO₃)₂ + 2·NO + 4·H₂O
Calculamos el mol de cada compuesto que interviene en la reacción:
8·HNO₃: 8·(1 g + 14 g + 3·16 g) = 504 g
3·Cu: 3·63,5 g = 190,5 g
3·Cu(NO₃)₂: 3·[63,5 g + 2·(14 g + 3·16 g)] = 562,5 g
2·NO: 2·(14 g + 16 g) = 60 g
4·H₂O: 4·(2·1 g + 16 g) = 72 g
![]()
a)
La masa de ácido nítrico será:
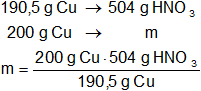
Resultado (a):
mácido nítrico = 529,13 g de HNO₃
b)
La masa de nitrato cúprico será:
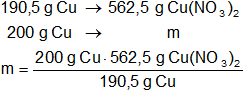
Resultado (b):
mnitrato cúprico = 590,55 g de Cu(NO₃)₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción