Problema nº 3 de estequiometria de las reacciones químicas, reactivos y productos - TP01
Enunciado del ejercicio nº 3
Se hacen reaccionar 5,5 litros de oxígeno medidos en CNPT con cantidad suficiente de nitrógeno, calcular:
a) Los moles de nitrógeno que reaccionan.
b) Volumen de nitrógeno necesario.
c) Número de moléculas del compuesto formado, sabiendo que se obtiene anhídrido nítrico.
Desarrollo
Datos:
Voxígeno = 5,5 l
CNPT
Solución
La ecuación de formación del anhídrido nítrico es la siguiente:
5·O₂ + 2·N₂ ⟶ 2·N₂O₅
Calculamos el mol de cada compuesto que interviene en la reacción:
5·O₂: 5·2·15,9994 g = 159,994 g
2·N₂: 2·2·14,0067 g = 56,0268 g
2·N₂O₅: 2·(2·14,0067 g + 5·15,9994 g) = 216,0208 g
![]()
Recordemos que en CNPT el volumen que ocupa un mol de gas es 22,4 litros, por lo tanto:
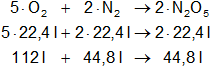
a)
Para calcular los moles nitrógeno:
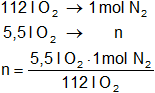
Resultado (a):
molnitrógeno = 0,098 mol de N₂
b)
Para calcular el volumen nitrógeno:
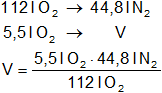
Resultado (b):
Vnitrógeno = 2,2 l de N₂
c)
Recordemos que en un mol hay 6,02·10²³ moléculas, luego:
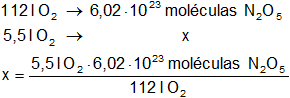
Resultado (c):
moléculas óxido nítrico = 2,96·10²² moléculas de N₂O₅
Problema corregido por: @AnaDahbar y Alejandro
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción