Problema nº 5 de estequiometria de las reacciones químicas, reactivos y productos - TP01
Enunciado del ejercicio nº 5
Se quieren obtener 15 litros de dióxido de carbono (CNPT) según la reacción:
Na₂CO₃ + 2·HCl ⟶ CO₂ + H₂O + 2·NaCl
Calcular:
a) Volumen de solución de HCl 38 % P/P (δ = 1,19 g/cm³) necesario.
b) Masa de Na₂CO₃ necesaria.
c) Masa de NaCl que se forma.
Desarrollo
Datos:
Vdióxido de carbono = 15 l
δHCl = 1,19 g/cm³
CNPT
Fórmulas:
δ = m/V
Solución
La ecuación estequiométrica balanceada es la siguiente:
Na₂CO₃ + 2·HCl ⟶ CO₂ + H₂O + 2·NaCl
Calculamos el mol de cada compuesto que interviene en la reacción:
Na₂CO₃: 2·23 g + 12 g + 3·16 g = 106 g
2·HCl: 2·(1 g + 35,5 g) = 73 g
CO₂: 12 g + 2·16 g = 44 g
H₂O: 2·1 g + 16 g = 18 g
2·NaCl: 2·(23 g + 35,5 g) = 117 g
![]()
a)
Para calcular el ácido clorhídrico:
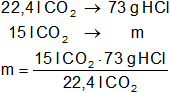
mHCl = 48,88 g de HCl puro.
Para calcular el volumen de solución de HCl 38 % p/p:
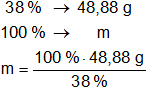
msolución = 100 %·48,88 g÷38 %
msolución = 128,63 g
Si δ = m/V ⇒ V = m/δ
V = 128,63 g/1,19 g/cm³
Resultado (a):
V = 108,1 cm³
b)
Para calcular la masa de Na₂CO₃:
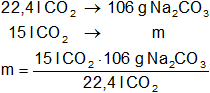
Resultado (b):
mcarbonato de sodio = 71 g de Na₂CO₃
c)
Para calcular la masa de NaCl:
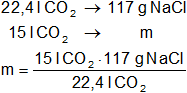
Resultado (c):
mcloruro de sodio = 78,35 g de NaCl
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción