Problema nº 6 de estequiometria de las reacciones químicas, reactivos y productos - TP01
Enunciado del ejercicio nº 6
El cobre reacciona con el ácido sulfúrico según la ecuación:
2·H₂SO₄ + Cu ⟶ SO₂ + CuSO₄ + 2·H₂O
Si se tienen 30 g de cobre y 200 g de H₂SO₄, calcular:
a) ¿Qué reactivo está en exceso y en qué cantidad?
b) Número de moles de SO₂ que se desprenden.
c) Masa de CuSO₄ que se forma.
Desarrollo
Datos:
mcobre = 30 g
mácido sulfúrico = 200 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·H₂SO₄ + Cu ⟶ SO₂ + CuSO₄ + 2·H₂O
Calculamos el mol de cada compuesto que interviene en la reacción:
2·H₂SO₄: 2·(2·1 g + 32 g + 4·16 g) = 196 g
Cu: 63,5 g
SO₂: 32 g + 2·16 g = 64 g
CuSO₄: 63,5 g + 32 + g 4·16 g = 159,5 g
2·H₂O: 2·(2·1 g + 16 g) = 36 g
![]()
a)
Para calcular el reactivo que está en exceso comenzamos por cualquiera de los involucrados:
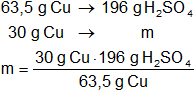
mácido sulfúrico = 92,6 g de H₂SO₄
200 g de H₂SO₄ - 92,6 g de H₂SO₄ = 107,4 g de H₂SO₄
Resultado, el ácido sulfúrico está en exceso y en la cantidad de:
107,4 g de H₂SO₄
A partir de acá tomamos como dato los 30 g de Cu.
b)
El número de moles de SO₂ que se desprenden será:
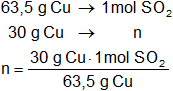
Resultado (b):
mdióxido de azufre = 0,47 mol de SO₂
c)
La masa de CuSO₄ será:
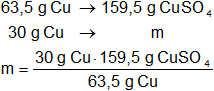
Resultado (c):
msulfato cúprico = 75,35 g de CuSO₄
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción