Problema nº 7 de estequiometria de las reacciones químicas, reactivos y productos - TP01
Enunciado del ejercicio nº 7
El ácido bromhídrico y el ácido sulfúrico reaccionan según la ecuación:
H₂SO₄ + 2·HBr ⟶ SO₂ + Br₂ + 2·H₂O
Si reaccionan 3 moles de H₂SO₄, calcular:
a) Masa de HBr necesaria.
b) Número de moles de Br₂ formados, sabiendo que la reacción tiene un rendimiento del 90 %.
c) Volumen de SO₂ que se desprende simultáneamente (medidos en CNPT).
Desarrollo
Datos:
Molesácido sulfúrico
ηreacción = 0,9 (90 %)
CNPT
Solución
La ecuación estequiométrica balanceada es la siguiente:
H₂SO₄ + 2·HBr ⟶ SO₂ + Br₂ + 2·H₂O
Calculamos el mol de cada compuesto que interviene en la reacción:
H₂SO₄: 2·1 g + 32 g + 4·16 g = 98 g
2·HBr: 2·(1 g + 80 g) = 162 g
SO₂: 32 g + 2·16 g = 64 g
Br₂: 2·80 g = 160 g
2·H₂O: 2·(2·1 g + 16 g) = 36 g
![]()
a)
La masa de HBr será:
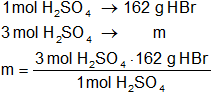
Resultado (a):
mácido bromhídrico = 486 g de HBr
b)
El número de moles de Br₂ formados al 100 %:
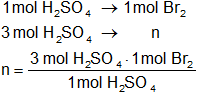
molbromo = 3 mol de Br₂ al 100 % de rendimiento.
molbromo 90 % = mol bromo·0,90 = 0,9·3 mol de Br₂
Resultado (b):
molbromo 90 % = mol bromo·0,90 = 2,7 mol de Br₂
c)
El volumen de dióxido de azufre es:
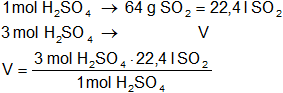
Resultado (c):
Vdióxido de azufre = 67,2 l de SO₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción