Problema nº 4 de estequiometria de las reacciones químicas, reactivos y productos - TP02
Enunciado del ejercicio nº 4
¿Cuántos gramos de ácido nítrico se necesitan para neutralizar 370 g hidróxido de calcio?
Desarrollo
Datos:
mhidróxido de calcio = 370 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
Ca(OH)₂ + 2·HNO₃ ⟶ Ca(NO₃)₂ + 2·H₂O
Calculamos el mol de cada compuesto que interviene en la reacción:
Ca(OH)₂: 40 g + 2·(16 g + 1 g) = 74 g
2·HNO₃: 2·(1 g + 14 g + 3·16 g) = 126 g
Ca(NO₃)₂: 40 g + 2·(14 g + 3·16 g) = 164 g
H₂O: 2·(2·1 g + 16 g) = 36 g
![]()
Mediante regla de tres simple calculamos que masa de hidróxido de calcio necesaria:
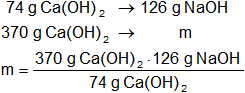
mácido nítrico = 630 g de HNO₃
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción