Problema nº 6 de estequiometria de las reacciones químicas, reactivos y productos - TP02
Enunciado del ejercicio nº 6
Calcular la masa de sulfato ácido de sodio que se obtiene tratando 2,92 kg de cloruro de sodio con ácido sulfúrico en cantidad suficiente. ¿Cuántos kilogramos de ácido clorhídrico gaseoso se obtienen? ¿Qué volumen ocupa ese gas?
Desarrollo
Datos:
mNaCl = 2,92 kg = 2.920 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
NaCl + H₂SO₄ ⟶ NaHSO₄ + HCl
Calculamos el mol de cada compuesto que interviene en la reacción:
NaCl: 23 g + 35,5 g = 58,5 g
H₂SO₄: 2·1 g + 32 g + 4·16 g = 98 g
NaHSO₄: 23 g + 1 g + 32 g + 4·16 g = 120 g
HCl: 1 g + 35,5 g = 36,5 g
![]()
Mediante regla de tres simple calculamos que masa de sulfato ácido de sodio necesaria:
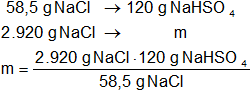
mNaHSO₄ = 6.000 g de NaHSO₄
mNaHSO₄ = 6 kg de NaHSO₄
Con el mismo método calculamos la masa de ácido clorhídrico resultante:
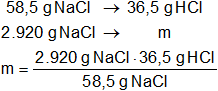
mHCl = 1821 g de HCl
mHCl = 1,821 kg de HCl
Según la ecuación estequiométrica se obtiene 1 mol de HCl que (en CNPT) equivale a 22,4 dm³. Entonces:
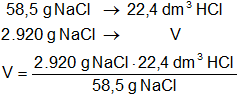
VHCl = 1.118 dm³ de HCl
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción