Problema nº 1 de estequiometria de las reacciones químicas, moles de los productos de reacción - TP04
Enunciado del ejercicio nº 1
¿Cuántos moles de hidrógeno gaseoso se producen al reaccionar 11,5 g de sodio metálico con un exceso de agua?
Desarrollo
Datos:
mNa = 11,5 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·Na + 2·H₂O ⟶ H₂ + 2·NaOH
Calculamos el mol de cada compuesto que interviene en la reacción:
2·Na: 2·23 g = 46 g
2·H₂O: 2·(2·1 g + 16 g) = 36 g
H₂: 2·1 g = 2 g
2·NaOH: 2·(23 g + 16 g + 1 g) = 80 g
![]()
Calculamos los moles de hidrógeno producidos:
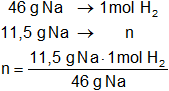
Resultado:
xH = 0,25 mol de H₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo determinar los moles de los productos de reacción