Problema nº 5 de estequiometria de las reacciones químicas, masas de las sustancias reaccionantes - TP04
Enunciado del ejercicio nº 5
La acción del monóxido de carbono sobre el óxido de hierro (III) puede representarse por la ecuación:
Fe₂O₃ + 3·CO ⇒ 2·Fe + 3·CO₂
¿Cuál sería la mínima cantidad de monóxido de carbono consumida si se produjeran 28 g de hierro?
Desarrollo
Datos:
mFe = 28 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
Fe₂O₃ + 3·CO ⟶ 2·Fe + 3·CO₂
Calculamos el mol de cada compuesto que interviene en la reacción:
Fe₂O₃: 2·56 g + 3·16 g = 160 g
3·CO: 3·(12 g + 16 g) = 84 g
2·Fe: 2·56 g = 112 g
3·CO₂: 3·(12 g + 2·16 g) = 132 g
![]()
Calculamos la masa de monóxido de carbono requerida:
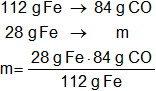
Resultado, los gramos de monóxido de carbono necesarios son:
xCO = 21 g de CO
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo determinar las masas de las sustancias reaccionantes