Problema nº 1 de estequiometria de las reacciones químicas, cantidades de las sustancias reaccionantes - TP05
Enunciado del ejercicio nº 1
¿Cuántos moles de hidróxido de bario son necesarios para neutralizar 490 g de ácido sulfúrico?
Desarrollo
Datos:
mH₂SO₄ = 490 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
Ba(OH)₂ + H₂SO₄ ⟶ BaSO₄ + 2·H₂O
Calculamos el mol de cada compuesto que interviene en la reacción:
Ba(OH)₂: 137,3 g + 2·(16 g + 1 g) = 171,3 g
H₂SO₄: 2·1 g + 32 g + 4·16 g = 98 g
BaSO₄: 137,3 g + 32 g + 4·16 g = 233,3 g
2·H₂O: 2·(2·1 g + 16 g) = 36 g
![]()
Mediante regla de tres simple calculamos los moles de hidróxido de bario necesarios:
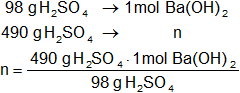
Resultado, los moles de hidróxido de bario necesarios son:
xBaOH = 5 moles de Ba(OH)₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, cómo determinar las cantidades de las sustancias reaccionantes