Problema nº 5 de estequiometria de las reacciones químicas, cantidades de los productos de reacción - TP05
Enunciado del ejercicio nº 5
El peróxido de hidrógeno (H₂O₂) se descompone fácilmente en agua y oxígeno gaseoso. ¿Qué volumen de oxígeno gaseoso en CNPT se obtendrá al descomponer 170 g de peróxido de hidrógeno? ¿Cuántos moles de agua se formarán?
Desarrollo
Datos:
mH₂O₂ = 170 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·H₂O₂ ⟶ 2·H₂O + O₂
Calculamos el mol de cada compuesto que interviene en la reacción:
2·H₂O₂: 2·(2·1 g + 2·16 g) = 68 g
2·H₂O: 2·(2·1 g + 16 g) = 36 g
O₂: 2·16 g = 32 g
![]()
Calculamos el volumen de oxígeno gaseoso producido:
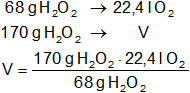
Resultado, el volumen de oxígeno producido en CNPT es:
VO₂ = 56 l de O₂
Calculamos los moles de agua obtenidos:
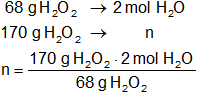
Resultado, los moles de agua producidos son:
xH₂O = 5 moles de H₂O
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, cómo determinar las cantidades de los productos de reacción