Problema nº 6 de gases ideales, volumen y moles de un gas - TP01
Enunciado del ejercicio nº 6
Sabiendo que la densidad del CO₂ es 1,965 g/dm³, calcular:
a) El volumen que ocupan 88 g del gas.
b) El número de moles presentes en 88 g del gas.
Desarrollo
Datos:
δ = 1,965 g/dm³
m = 88 g
Vmol = 22,4 dm³ CNPT
Fórmulas:
![]()
Solución
a)
Aplicamos la fórmula dada despejando "V":
![]()
![]()
Reemplazamos por los datos y calculamos:
![]()
Resultado, el volumen de CO₂ es:
V = 44,784 dm³
b)
Calculamos la masa de un mol de CO₂:
PM de CO₂: 12,01115 g + 2·15,9994 g = 44,00995 g
Mediante regla de tres simple calculamos la cantidad de moles:
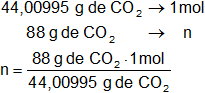
Resultado, los moles de CO₂ es:
n = 1,965 moles de CO₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar el volumen y los moles de un gas