Problema nº 7 de gases ideales, masa y moles de un gas - TP01
Enunciado del ejercicio nº 7
Se tienen 0,03 m³ de gas amoníaco (NH₃) en un recipiente cerrado, calcular:
a) Moles.
b) Moléculas.
c) Masa.
d) Atomicidad.
Desarrollo
Datos:
VNH₃ = 0,03 m³ = 30 dm³
Vmol = 22,4 dm³ CNPT
Solución
a)
Mediante regla de tres simple calculamos la cantidad de moles:
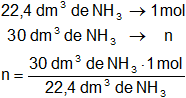
Resultado, los moles de NH₃ es:
n = 1,34 moles de NH₃
b)
Sabemos que en mol de cualquier gas en CNPT hay 6,02·10²³ moléculas y 22,4 dm³.
Calculamos las moléculas de NH₃:
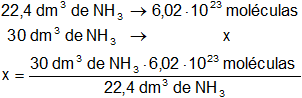
Resultado, las moléculas de NH₃ es:
x = 8,0625·10²³ moléculas de NH₃
c)
Calculamos la masa de un mol de NH₃:
PM de NH₃: 14,0067 g + 3·1,00797 g = 17,03061 g
Calculamos la masa de NH₃ presente:

Resultado, la masa de NH₃ es:
m = 22,8089 g de NH₃
d)
Resultado, la atomicidad de un mol de NH₃ es 4 heteroatómica
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar el volumen, la masa y los moles de un gas