Problema nº 8 de gases ideales, masa de un gas - TP02
Enunciado del ejercicio nº 8
Calcular los gramos de óxido de mercurio que se deben descomponer para obtener:
a) 112 dm³ de O₂ en CNPT.
b) 320 g de oxígeno.
c) 4 moles de oxígeno.
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·HgO ⟶ 2·Hg + O₂
Calculamos las masas de los moles que intervienen en la reacción en equilibrio:
2·HgO: 2·(200,59 g + 15,9994 g) = 433,1788 g
2·Hg: 2·200,59 = 401,18 g
O₂: 2·15,9994 g = 31,9988 g
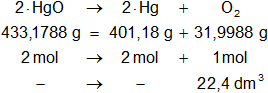
a)
Mediante regla de tres simple calculamos la masa de óxido de mercurio que se deben descomponer para obtener 112 dm³ de O₂ en CNPT:
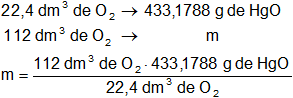
m = 2.165,894 g de HgO
b)
Calculamos la masa de óxido de mercurio que se deben descomponer para obtener 320 g de O₂ en CNPT:
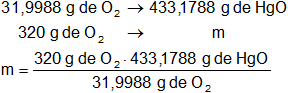
m = 4.331,95 g de HgO
c)
Calculamos la masa de óxido de mercurio que se deben descomponer para obtener 4 moles de O₂ en CNPT:
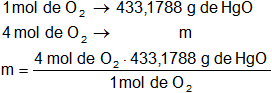
m = 1.732,715 g de HgO
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar la masa de un gas