Problema nº 5 de ecuación de estado de los gases ideales, fracción molar y presiones parciales - TP17
Enunciado del ejercicio nº 5
En un matraz para gases de 2,83 litros se introducen 0,174 g de H₂ y 1,365 g de N₂, a los que se supone comportamiento ideal. La temperatura es de 0 °C.
a) ¿Cuáles son las fracciones molares de cada gas?
b) ¿Cuál es la presión total y cuales son las presiones parciales de cada gas?
Desarrollo
Datos:
V = 2,83 l
mH₂ = 0,174 g
mN₂ = 1,365 g
t = 0 °C
Fórmulas:
p·V = n·R·T
pT = ∑pg
Solución
a)
Calculamos el número de moles de cada elemento que hay en la mezcla y el n total. Armamos la tabla de contingencia:
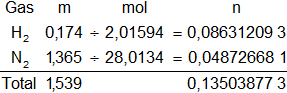
nₜ = 0,135038773
Hallamos la fracción molar de cada gas:
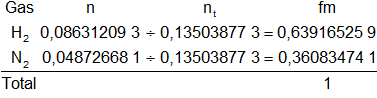
Resultado a), las fracciones molares de cada gas son:
fmH₂ = 0,64
fmN₂ = 0,36
b)
Aplicamos la ecuación de estado de los gases ideales:
p·V = n·R·T
Despejamos p:
![]()
Convertimos las unidades de temperatura:
T₁ = 273 °C + 0 °C = 273 K
Reemplazamos por los valores y calculamos:
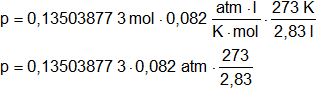
pT = 1,068841435 atm
Con éste valor aplcamos la ecuación de las presiones parciales de los gases:
pT = ∑pg

Resultado b), la presión total y las presiones parciales de cada gas son:
pT = 1,07 atm
pH₂ = 0,68 atm
pN₂ = 0,39 atm
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP17
- | Siguiente ›
Ejemplo de cómo determinar las presiones parciales y las fracciones molares