Problema nº 4 de volumen y masa molar - TP03
Enunciado del ejercicio nº 4
¿Cuál es la masa de un litro de los siguientes gases en CNPT? Hidrógeno (2 g), dióxido de carbono (44 g), monóxido de nitrógeno (30 g) y cloro (71 g).
Desarrollo
Datos:
V gas = 1 l = 1 dm³
Mol H = 2 g
Mol CO₂ = 44 g
Mol NO = 30 g
Mol Cl = 71 g
El volumen molar (volumen de un mol de gas) de los gases en CNPT es igual para todos y su valor es 22,4 dm³.
Solución
a) Hidrógeno
Calculamos la masa de H₂ contenida en 1 dm³ en CNPT:
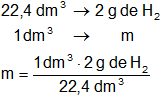
m = 0,089 g de H₂
Respuesta a): la masa de un litro de hidrógeno en CNPT es 0,09 g
b) Dióxido de carbono
Calculamos la masa de CO₂ contenida en 1 dm³ en CNPT:
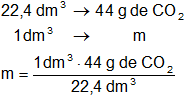
m = 1,964 g de CO₂
Respuesta b): la masa de un litro de dióxido de carbono en CNPT es 1,96 g
c) Monóxido de nitrógeno
Calculamos la masa de NO contenida en 1 dm³ en CNPT:

m = 1,339 g de NO
Respuesta c): la masa de un litro de monóxido de nitrógeno en CNPT es 1,34 g
d) Cloro
Calculamos la masa de Cl₂ contenida en 1 dm³ en CNPT:
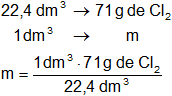
m = 3,169 g de Cl₂
Respuesta d): la masa de un litro de cloro en CNPT es 3,17 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular la masa de un gas dado el volumen