Problema nº 1-c de compuestos orgánicos, composición centesimal de un compuesto - TP01
Enunciado del ejercicio nº 1-c
Calcular la composición centesimal de cada elemento en el siguiente compuesto:
CH₃I
Solución
La masa de cada elemento que interviene es:
1 C = 12 g
3 H = 3·1 g = 3 g
1 I = 127 g
Calculamos el mol del compuesto que corresponde al 100%:
CH₃I: 12 g + 3 g + 127 g = 142 g
Aplicamos regla de tres simple y calculamos el porcentaje de cada elemento.
Para el carbono:
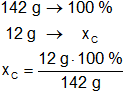
Resultado, el porcentaje de carbono es:
xC = 8,45 %
Para el hidrógeno:
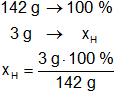
Resultado, el porcentaje de hidrógeno es:
xH = 2,11 %
Para el yodo:

Resultado, el porcentaje de yodo es:
xI = 89,44 %
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la composición centesimal de un compuesto