Problema nº 3 de compuestos orgánicos, composición centesimal de un compuesto - TP01
Enunciado del ejercicio nº 3
Se ha analizado una sustancia nitrogenada y se ha encontrado 0,2534 g de NH₃, habiendo partido de 1,257 g de muestra. ¿Qué porcentaje de N posee la muestra?
Solución
Calculamos el mol del compuesto hallado:
NH₃: 14 g + 3·1 g = 17 g
Calculamos la masa de nitrógeno en el compuesto:
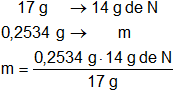
m = 0,2087 g de nitrógeno
Calculamos el porcentaje de nitrógeno en la muestra:
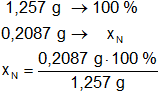
Resultado, el porcentaje de nitrógeno es:
xN = 16,60 %
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la composición centesimal de un compuesto