Problema nº 5 de compuestos orgánicos, fórmula molecular de un compuesto - TP01
Enunciado del ejercicio nº 5
Siendo la composición centesimal de una sustancia la siguiente:
C: 39,34 % H: 8,19 % O: 52,5 %
y su peso molecular de 122, ¿cuál será su fórmula?
Solución
Calculamos las masas de carbono, hidrógeno y oxígeno en el hidrocarburo:
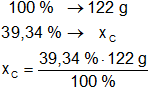
Resultado, la masa de carbono es:
xC = 47,7386 g
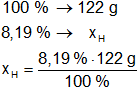
Resultado, la masa de hidrógeno es:
xH = 10,6140 g
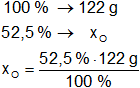
Resultado, la masa de oxígeno es:
xO = 63,6474 g
Calculamos la fórmula molecular dividiendo las masas halladas por el peso atómico de cada elemento.
![]()
nC = 4 átomos
![]()
nH = 10 átomos
![]()
nO = 4 átomos
Resultado, la fórmula molecular es:
C₄H₁₀O₄: 1,2,3,4-tetraol-butano
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la fórmula molecular de un compuesto