Problema nº 5-a de ecuaciones de óxido reducción, equilibrar por el método del ion electrón - TP01
Enunciado del ejercicio nº 5-a
Igualar la siguiente ecuación por el método del ion electrón:
HNO₃ + CdS ⟶ Cd(NO₃)₂ + NO + S + H₂O
Reacción de oxidación del sulfuro de cadmio por el ácido nítrico con formación de azufre libre y óxido nítrico.
Solución
Primero disociamos los compuestos detallando el número de oxidación:
HNO₃ + CdS ⟶ Cd(NO₃)₂ + NO + S + H₂O
H⁺ + NO₃⁻ + Cd²⁺ + S²⁻ ⟶ Cd²⁺ + 3·NO₃⁻ + NO + S° + H⁺ + OH⁻
Identificamos los elementos que se reducen y los que se oxidan. Recordar que si un elemento se reduce hay otro que se oxida.
El S²⁻ pasa a S°, se oxidó.
El N⁵⁺ pasa a N²⁺, se reduce.
Ahora armamos las hemireacciones:
![]()
Ahora equilibramos los electrones, si es necesario, sumando los signos +/- que hay de ambos lados del igual:
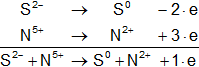
Hay que equilibrar los electrones, multiplicando cada hemireacción por el número opuesto de los electrones:
![]()
Calculamos:
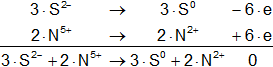
Volvemos a la primera ecuación y la armamos con los nuevos coeficientes:
2·HNO₃ + 3·CdS ⟶ Cd(NO₃)₂ + 2·NO + 3·S + H₂O
Terminamos de equilibrar la ecuación:
8·HNO₃ + 3·CdS ⟶ 3·Cd(NO₃)₂ + 2·NO + 3·S + 4·H₂O
La ecuación queda igualada.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de equilibrar ecuaciones por el método del ion electrón