Problema nº 5-b de ecuaciones de óxido reducción, equilibrar por el método del ion electrón - TP01
Enunciado del ejercicio nº 5-b
Igualar la siguiente ecuación por el método del ion electrón:
KMnO₄ + HCl ⟶ KCl + MnCl₂ + H₂O + Cl₂
Reacción de oxidación del ácido clorhídrico por el ion permanganato con formación de cloruro de manganeso y cloro libre.
Solución
Primero disociamos los compuestos, detallando los signos correspondientes:
KMnO₄ + HCl ⟶ KCl + MnCl₂ + H₂O + Cl₂
K⁺ + MnO₄⁻ + H⁺ + Cl⁻ ⟶ K⁺ + Cl⁻ + Mn²⁺ + 2·Cl⁻ + H⁺ + OH⁻ + Cl₂°
Identificamos los elementos que se reducen y los que se oxidan. Recordar que si un elemento se reduce hay otro que se oxida.
Veamos uno por uno:
K⁺: queda igual de ambos lados del "=" (⟶).
MnO₄⁻: pasa a Mn²⁺, captó 5 electrones, se redujo.
H⁺: queda igual de ambos lados del "=" (⟶), no confundir con el OH⁻.
Cl⁻: pasa a Cl₂°, perdió 1 electrón, se oxidó, pasó a estado gaseoso libre.
Ahora armamos las hemireacciones:
![]()
Compensamos el cloro, el hidrógeno y el oxígeno con iones OH⁻:
![]()
Ahora equilibramos los electrones, si es necesario, sumando los signos +/- que hay de ambos lados del igual:
![]()
Hay que equilibrar los electrones, multiplicando cada hemireacción por el número opuesto de los electrones:
![]()
Hacemos cuentas:
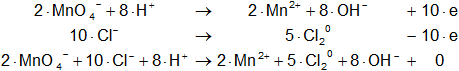
Volvemos a la primera ecuación y la armamos con los nuevos coeficientes:
2·KMnO₄ + 10·HCl ⟶ KCl + 2·MnCl₂ + 8·H₂O + 5·Cl₂
Terminamos de equilibrar "a ojo" el K y los H:
2·KMnO₄ + 16·HCl ⟶ 2·KCl + 2·MnCl₂ + 8·H₂O + 5·Cl₂
Debes tomar todo esto como cuentas matemáticas, todo debe quedar igualado.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de equilibrar ecuaciones por el método del ion electrón