Problema nº 5-d de ecuaciones de óxido reducción neta, igualación en forma iónica neta - TP04
Enunciado del ejercicio nº 5-d
Balancee la siguiente ecuación después de haberla expresado en forma iónica neta:
HNO₃(aq) + H₂SO₄(aq) + Hg(l) ⟶ Hg₂SO₄(s) + NO(g) + H₂O(l)
Solución
Reacción de oxidación del mercurio libre por el ácido nítrico con formación de sulfato de mercurio y óxido nítrico.
HNO₃(aq) + H₂SO₄(aq) + Hg(l) ⟶ Hg₂SO₄(s) + NO(g) + H₂O(l)
La siguiente reacción se realiza en medio acuoso.
Expresamos las sustancias en forma iónica y/o molecular según corresponda.
H⁺ + NO₃⁻ + 2·H⁺ + SO₄²⁻ + Hg° ⟶ Hg₂SO₄ + NO + H₂O
El sulfato mercurioso no es soluble en agua.
El Hg° pasa a Hg₂SO₄, se oxida, cede 1 electrón.
El NO₃⁻ pasa a NO, se reduce, capta 3 electrones.
Presentamos en la ecuación solo los iones o moléculas que intervienen en la oxidación-reducción, es decir en forma iónica neta.
NO₃⁻ + H⁺ + SO₄²⁻ + Hg° ⟶ Hg₂SO₄ + NO + H₂O
Semirreacción de reducción:
NO₃⁻ ⟶ NO
Equilibramos los electrones:
NO₃⁻ + 3·e ⟶ NO
Agregamos agua para compensar el oxgíeno y equilibramos:
NO₃⁻ + 3·e ⟶ NO + 2·H₂O
Compensamos el hidrógeno y equilibramos:
NO₃⁻ + 3·e + 4·H⁺ ⟶ NO + 2·H₂O (1)
Semirreacción de oxidación:
2·Hg° ⟶ Hg₂SO₄
Equilibramos los electrones:
2·Hg° - 2·e ⟶ Hg₂SO₄
Compensamos el ion sulfato y equilibramos:
2·Hg° - 2·e + SO₄²⁻ ⟶ Hg₂SO₄ (2)
Se conserva la clase y la masa de los elementos (Ley de Lavoisier), sus cargas no cuentan.
El balance de la carga está equilibrado en cada semirreacción.
La ecuación completa es (1) y (2):
![]()
Multiplicamos apropiadamente las ecuaciones para poder simplificar los electrones:
![]()
Sumamos las ecuaciones miembro a miembro:
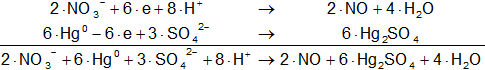
2·NO₃⁻ + 6·Hg° + 8·H⁺ + 3·SO₄²⁻ ⟶ 2·NO + 3·Hg₂SO₄ + 4·H₂O
La ecuación queda igualada en forma iónica neta.
Escribimos la reacción completa con los nuevos coeficientes:
2·HNO₃ + 3·H₂SO₄ + 6·Hg ⟶ 3·Hg₂SO₄ + 2·NO + 4·H₂O
La ecuación completa queda igualada.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo igualar ecuaciones redox en forma iónica neta