Problema nº 1-d de estequiometría de las disoluciones, fracción molar - TP04
Enunciado del ejercicio nº 1-d
Calcular la fracción molar de la siguiente solución:
67,4 g de C₉H₇N en 200 g de C₂H₆O.
Desarrollo
Datos:
Soluto = 67,4 g de C₉H₇N
Disolvente = 200 g de C₂H₆O
Solución
Calculamos el peso molecular de los componentes:
C₉H₇N: 9·12 g + 7·1 g + 14 g = 129 g
C₂H₆O: 2·12 g + 6·1 g + 16 g = 46 g
Calculamos cuántos moles hay de cada componente en la solución:
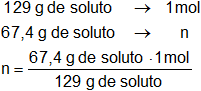
n = 0,522 moles de soluto

n = 4,345 moles de disolvente
Calculamos la fracción molar del soluto:
![]()
Resultado, la fracción molar del soluto es:
ƒm = 0,107
La fracción molar del disolvente (disv) es:
![]()
ƒm = 0,893
Si sumamos las fracciones molares debe resultar "1":
0,107 + 0,893 = 1 ∎
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular la fracción molar de una disolución