Problema nº 2-a de estequiometría de las disoluciones, molalidad - TP04
Enunciado del ejercicio nº 2-a
Calcule la masa de soluto (st) necesaria que debe disolverse en la cantidad dada de disolvente:
KOH en 1.000 g de agua para preparar una solución 0,75 m.
Desarrollo
Datos:
C = 0,75 m
Disolvente = 1.000 g de agua
Solución
Molalidad (m): es el número de moles de soluto (st) que tiene una solución por 1.000 g de disolvente (disv).
Calculamos el peso molecular del KOH (hidróxido de potasio):
KOH: 39 g + 1 g + 16 g = 56 g
Calculamos cuántos moles de KOH necesarios para preparar la solución:
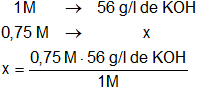
Resultado, la masa de soluto (st) necesaria que debe disolverse en 1.000 g de agua es:
x = 42 g de KOH/1.000 g de agua
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular el soluto en una disolución molal