Problema nº 2-c de estequiometría de las disoluciones, molalidad - TP04
Enunciado del ejercicio nº 2-c
Calcule la masa de soluto (st) necesaria que debe disolverse en la cantidad dada de disolvente:
LiMnO₄ que debe agregarse a 1.000 g de agua para preparar una solución 0,61 m.
Desarrollo
Datos:
C = 0,61 m
Disolvente = 1.000 g de agua
Solución
Molalidad (m): es el número de moles de soluto (st) que tiene una solución por 1.000 g de disolvente (disv).
Calculamos el peso molecular del LiMnO₄ (permanganato de litio):
LiMnO₄: 7 g + 55 g + 4·16 g = 126 g
Calculamos cuántos moles de LiMnO₄ necesarios para preparar la solución:
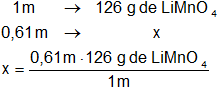
Resultado, la masa de soluto (st) necesaria que debe disolverse en 1.000 g de agua es:
x = 76,86 g de LiMnO₄/1.000 g de agua
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular el soluto en una disolución molal