Problema nº 3 de fórmula mínima de un compuesto hidratado - TP09
Enunciado del ejercicio nº 3
Una muestra de 15 gramos de una sal hidratada inestable, Na₂SO₄•x·H₂O, se halló que contiene 7,05 gramos de agua. Determinar la fórmula mínima de la sal.
Solución
En 15 g de muestra hay 7,05 g de agua, por tanto, la cantidad de sulfato de sodio es:
15 g - 7,05 g = 7,95 g
Calculamos los pesos moleculares de cada sustancia.
Los pesos atómicos de los elementos presentes en el sulfato de sodio son:
mNa = 22,9898 g
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
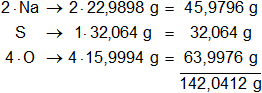
molNa₂SO₄ = 142,0412 g
Los pesos atómicos de los elementos presentes en el agua son:
mH = 1,00797 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
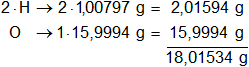
molH₂O = 18,01534 g
Calculamos los moles de sulfato de sodio contenidos en 7,95 g de Na₂SO₄:
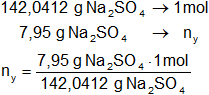
ny = 0,055969676 moles de Na₂SO₄
Calculamos los moles de agua contenidos en 7,05 g de H₂O:

nx = 0,391333164 moles de H₂O
El número de moles de cada sustancia debe ser entero, dividimos por el menor valor:
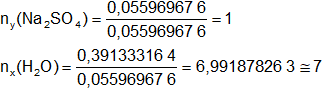
Respuesta: la fórmula mínima de la sal es:
Na₂SO₄•7·H₂O
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplos de cómo calcular la fórmula mínima